- Kirjoittaja Alex Aldridge [email protected].
- Public 2023-12-17 13:38.
- Viimeksi muokattu 2025-06-01 07:36.
Avainero ensimmäisen ja toisen kertaluvun reaktioiden välillä on, että ensimmäisen kertaluvun reaktioiden nopeus riippuu lähtöaineen pitoisuuden ensimmäisestä potenssista nopeusyhtälössä, kun taas toisen kertaluvun reaktioiden nopeus riippuu pitoisuuden toisesta potenssista termi kurssiyhtälössä.
Reaktion järjestys on niiden potenssien summa, joihin reagoivien aineiden pitoisuudet nostetaan nopeuslain yhtälössä. Tämän määritelmän mukaan on olemassa useita reaktioiden muotoja; nolla-asteen reaktiot (nämä reaktiot eivät riipu lähtöaineiden pitoisuudesta), ensimmäisen asteen reaktiot ja toisen asteen reaktiot.
Mitä ovat ensimmäisen asteen reaktiot?
Ensimmäisen kertaluvun reaktiot ovat kemiallisia reaktioita, joiden reaktionopeus riippuu jonkin reaktioon osallistuvan reagoivan aineen moolipitoisuudesta. Siksi edellä olevan reaktiojärjestyksen määritelmän mukaan niiden tehojen summa, joihin lähtöainepitoisuudet nostetaan nopeuslain yhtälössä, on aina 1. Näihin reaktioihin voi osallistua joko yksi lähtöaine. Sitten kyseisen reagoivan aineen pitoisuus määrittää reaktion nopeuden. Mutta joskus näihin reaktioihin osallistuu useampi kuin yksi lähtöaine, jolloin yksi näistä lähtöaineista määrittää reaktion nopeuden.
Katsotaanpa esimerkkiä tämän käsitteen ymmärtämiseksi. N2O5 hajoamisreaktiossa se muodostaa NO2 ja O 2 kaasuja tuotteina. Koska siinä on vain yksi lähtöaine, voimme kirjoittaa reaktion ja nopeusyhtälön seuraavasti.
2N2O5(g) → 4NO2(g) + O 2(g)
Hinnoittelu=k[N2O5(g)]m
Tässä k on tämän reaktion nopeusvakio ja m on reaktion järjestys. Siksi kokeellisista määrityksistä m:n arvo on 1. Tämä on siis ensimmäisen asteen reaktio.
Mitä ovat toisen asteen reaktiot?
Toisen kertaluvun reaktiot ovat kemiallisia reaktioita, joiden reaktionopeus riippuu kahden reagoivan aineen moolipitoisuudesta tai yhden reaktioon osallistuneen lähtöaineen toisesta tehosta. Siksi edellä olevan reaktiojärjestyksen määritelmän mukaan tehojen summa, joihin lähtöaineiden pitoisuudet nostetaan nopeuslain yhtälössä, on aina 2. Jos lähtöaineita on kaksi, reaktionopeus riippuu ensimmäisestä potenssista kunkin lähtöaineen pitoisuudesta.
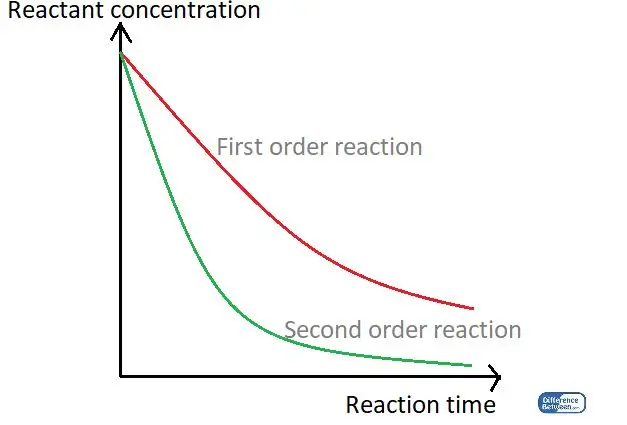
Kuva 01: Kaavio, jossa verrataan kahta reaktiojärjestystä käyttämällä niiden reaktioaikaa ja reagoivan aineen pitoisuutta.
Jos lisäämme reagoivan aineen pitoisuutta 2 kertaa (jos nopeusyhtälössä on kaksi lähtöainetta), reaktionopeus kasvaa 4 kertaa. Tarkastellaanpa esimerkiksi seuraavaa reaktiota.
2A → P
Tässä A on lähtöaine ja P on tuote. Sitten jos tämä on toisen asteen reaktio, tämän reaktion nopeusyhtälö on seuraava.
Hinnoittelu=k[A]2
Mutta reaktio kahdella eri reagenssilla, kuten seuraava;
A + B → P
Hinnoittelu=k[A]1[B]1
Mitä eroa on ensimmäisen ja toisen asteen reaktioilla?
Ensimmäisen kertaluvun reaktiot ovat kemiallisia reaktioita, joiden reaktionopeus riippuu jonkin reaktioon osallistuvan reagoivan aineen moolipitoisuudesta. Siksi, jos lisäämme reagoivan aineen pitoisuutta 2 kertaa, reaktionopeus kasvaa 2 kertaa. Toisen asteen reaktiot ovat kemiallisia reaktioita, joiden reaktionopeus riippuu kahden reagoivan aineen moolipitoisuudesta tai yhden reaktioon osallistuneen lähtöaineen toisesta tehosta. Näin ollen, jos lisäämme reagoivan aineen pitoisuutta 2 kertaa, reaktionopeus kasvaa 4 kertaa. Alla oleva infografiikka esittää erot ensimmäisen ja toisen asteen reaktioiden välillä taulukkomuodossa.

Yhteenveto - Ensimmäisen vs. toisen asteen reaktiot
Reaktioiden järjestyksen mukaan on kolme päätyyppiä; nolla-, ensimmäisen ja toisen asteen reaktiot. avainero ensimmäisen ja toisen kertaluvun reaktioiden välillä on se, että ensimmäisen kertaluvun reaktion nopeus riippuu lähtöaineen pitoisuuden ensimmäisestä potenssista nopeusyhtälössä, kun taas toisen kertaluvun reaktion nopeus riippuu pitoisuustermin toisesta potenssista korkoyhtälö.






