- Kirjoittaja Alex Aldridge [email protected].
- Public 2023-12-17 13:38.
- Viimeksi muokattu 2025-06-01 07:36.
Avainero hiilihapon ja bikarbonaatin välillä on, että hiilihappo on neutraali kemiallinen yhdiste, kun taas bikarbonaatti on negatiivisesti varautunut kemiallinen yhdiste.
Hiilihappo on heikko happo, joka muodostuu liuoksessa, kun hiilidioksidi liukenee veteen ja jonka kemiallinen kaava on H2CO3. Bikarbonaatti muodostuu kolmen happiatomin, vetyatomin ja hiiliatomin yhdistelmästä, jonka kemiallinen kaava on HCO3-.
Mikä on hiilihappo?
Hiilihappo on H2CO3. Joskus annamme tämän nimen liuoksille, joissa on veteen tai hiilihapotettuun veteen liuotettua hiilidioksidia. Tämä johtuu siitä, että hiilihapotettu vesi sisältää pienen määrän H2CO3:a. Lisäksi hiilihappo on heikko happo, ja se voi muodostaa kahdenlaisia suoloja karbonaatteina ja bikarbonaatteina. Tämän yhdisteen moolimassa on 62,024 g/mol.
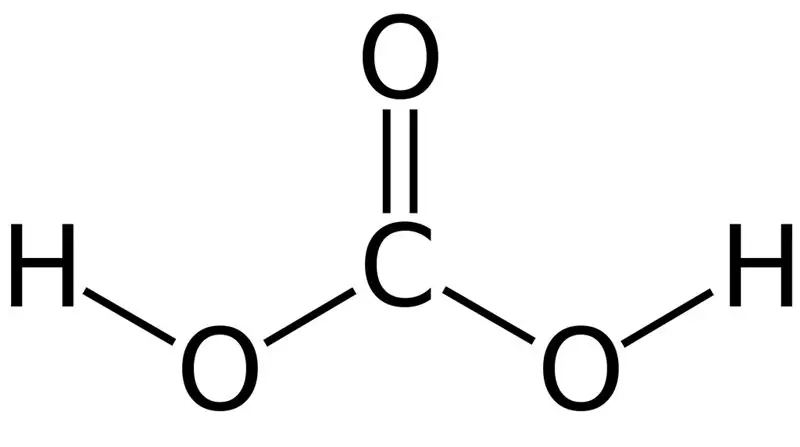
Kuva 01: Hiilihapon kemiallinen rakenne
Kun hiilidioksidi liukenee veteen, se saavuttaa tasapainon hiilidioksidin ja hiilihapon välillä. Tasapaino on seuraava:
CO2 + H2O ⟷ H2CO3
Jos lisäämme ylimäärän hiilihappoa emäkseen, saadaan bikarbonaattia. Mutta jos emästä on ylimäärä, hiilihapolla on taipumus tuottaa hiilihapotettuja suoloja. Tarkemmin sanottuna hiilihappo on karboksyylihappoyhdiste, jossa on kaksi hydroksyyliryhmäsubstituenttia kiinnittyneenä karbonyylihiileen. Lisäksi se on polyproottinen happo, joka pystyy luovuttamaan protoneja. Siinä on kaksi irrotettavaa protonia, joten se on erityisen diproottinen.
Mikä on bikarbonaatti?
Bikarbonaatti muodostuu kolmen happiatomin, vetyatomin ja hiiliatomin yhdistelmällä. Tämän yhdistelmän tuote voi olla ioni tai yhdiste, jossa on enemmän elektroneja kuin protoneja. Voimme kuvata sitä kemialliseksi lajiksi, jonka kemiallinen kaava on HCO3-.
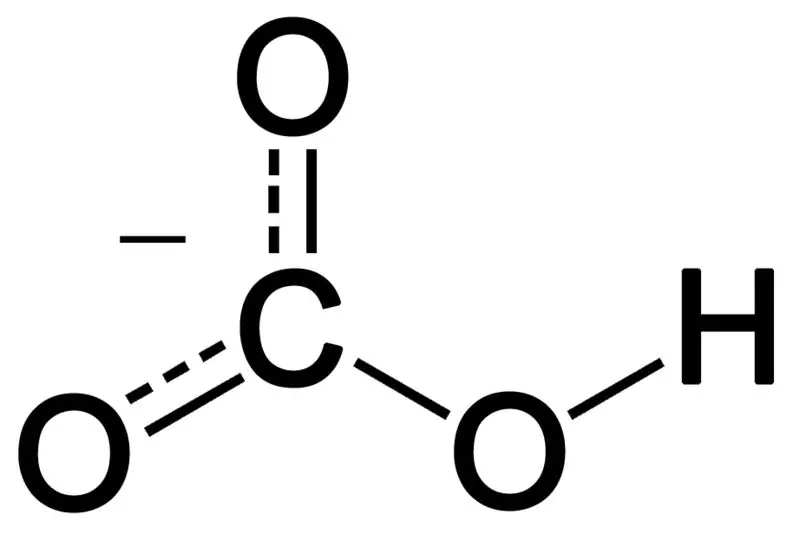
Kuva 02: Bikarbonaattianionin kemiallinen rakenne
Tämä yhdiste on tärkeä osa kehon pH-puskurointijärjestelmää maallikollisesti sanottuna: se on vastuussa veren pitämisestä tilassa, joka ei ole liian hapan tai liian emäksinen. Lisäksi se toimii tapana pitää ruoansulatusnesteet kurissa, kun vatsa on lopettanut ruoansulatuksen. Lisäksi sadeveden hiilihappo muodostaa bikarbonaatti-ioneja osuessaan kiviin. Tämä bikarbonaatti-ionien virtaus on tärkeä hiilikierron ylläpitämiseksi.
Mitä eroa on hiilihapolla ja bikarbonaatilla?
Hiilihappo on heikko happo, joka muodostuu liuoksessa, kun hiilidioksidi liukenee veteen, ja sen kemiallinen kaava on H2CO3. Bikarbonaatti muodostuu kolmen happiatomin, vetyatomin ja hiiliatomin yhdistelmästä, jonka kemiallinen kaava on HCO3-. Keskeinen ero hiilihapon ja bikarbonaatin välillä on, että hiilihappo on neutraali kemiallinen yhdiste, kun taas bikarbonaatti on negatiivisesti varautunut kemiallinen yhdiste. Lisäksi hiilihappoa käytetään kuplivien, poreilevien juomien valmistuksessa, ihotulehdusten hoidossa, suuvedessä jne., kun taas bikarbonaattia käytetään elintarvikkeissa, kuten leivonnassa (kovetusaineena), ja se antaa kyvyn vastustaa pH-muutoksia.
Seuraava infografiikka esittää yhteenvedon hiilihapon ja bikarbonaatin välisestä erosta taulukkomuodossa vierekkäin vertailua varten.
Yhteenveto - hiilihappo vs. bikarbonaatti
Hiilihappo on H2CO3. Bikarbonaatti muodostuu kolmen happiatomin, vetyatomin ja hiiliatomin yhdistelmästä, jonka kemiallinen kaava on HCO3-. avainero hiilihapon ja bikarbonaatin välillä on, että hiilihappo on neutraali kemiallinen yhdiste, kun taas bikarbonaatti on negatiivisesti varautunut kemiallinen yhdiste.






