- Kirjoittaja Alex Aldridge [email protected].
- Public 2023-12-17 13:38.
- Viimeksi muokattu 2025-06-01 07:36.
Avainero alfa- ja beetakierteen välillä riippuu vetysidoksen tyypistä, jonka ne muodostavat kehitettäessä näitä rakenteita. Alfa-kierteet muodostavat molekyylin sisäisiä vetysidoksia, kun taas beetaheliksit muodostavat molekyylien välisiä vetysidoksia.
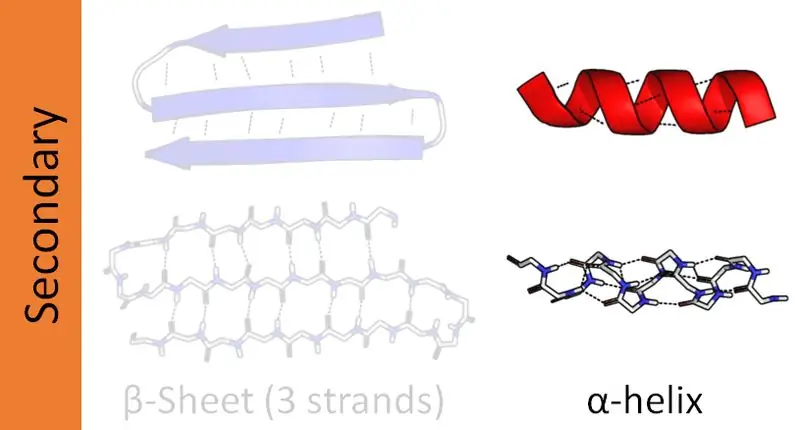
Monimutkaisilla proteiineilla on neljä rakenteellista organisaatiotasoa - primaarinen, sekundaarinen, tertiäärinen ja kvaternäärinen. Proteiinien sekundaarirakenteet muodostavat peptidiketjut eri orientaatioissa. Peptidiketjut koostuvat aminohapposekvensseistä, jotka on sidottu peptidisidoksilla. Siksi proteiineissa on kaksi pääasiallista toissijaista rakennetta, alfaheliksi ja beetaheliksi. Lisäksi on muita toissijaisia rakenteita, joita kutsutaan beetakäännöksiksi ja hiusneularakenteiksi. Tämä artikkeli keskittyy pääasiassa alfa- ja beetakierteen eroon.
Mikä on Alpha Helix?
Proteiineilla on neljä rakenteellista organisaatiotasoa. Näistä alfaheliksi on yleisin proteiinien toissijainen rakenne. Ja tämä rakenne näyttää sauvana, joka on kierretty keskusakselin ympärille. Lisäksi alfahelix on oikeakätinen heliksi. Vasenkätisiä helikkejä voi kuitenkin olla myös läsnä. Tässä peptidisidokset muodostuvat aminopäästä karboksipäähän. Aminohapot kytkeytyvät toisiinsa näiden peptidisidosten kautta. Molekyylien sisäiset vetysidokset ovat tärkein syy alfakierteen muodostumiseen.
Kuva 01: Alpha Helix
Alfa-kierteen järjestely riippuu proteiinin hydrofiilisestä ja hydrofobisesta luonteesta. Jos aminohapposekvenssi koostuu suuresta määrästä hydrofiilisiä (muuttuvia) R-ryhmiä, R-ryhmät orientoituvat vesifaasiin. Jos muuttuvat ryhmät ovat hydrofobisia, ne työntyvät ympäristön hydrofobiseen vaiheeseen. Kummassakin skenaariossa R-ryhmät näyttävät ulottuvan ulos kierteisestä rakenteesta. Näiden rakenteellisten ominaisuuksien ansiosta alfaheliksi on vastustuskykyisempi mutaatioille. Siten vetysidosten läsnäolo stabiloi alfaheliksin rakennetta. Alfakierteessä on keskimäärin 3,6 jäännöstä kierrosta kohden, koska vetysidosten kehittymiseen tarvitaan 3,6 jäännöstä. Jotkut rakenneproteiinit, kuten kollageeni ja keratiini, sisältävät runsaasti alfahelksejä.
Mikä on Beta Helix?
Beetaheliksi on proteiinin toiseksi yleisin toissijainen rakenne. Vaikka se ei ole yhtä yleinen kuin alfaheliksi, beetaheliksien läsnäolo on myös tärkeä rooli proteiinin rakenteessa. Beeta-heliksin muodostuminen tapahtuu kahden beetalevyn kautta, jotka on järjestetty joko rinnakkain tai anti-rinnakkaismaisesti. Nämä levyt muodostavat sitten kierteisen rakenteen. Molekyylien väliset vetysidokset kahden levysäikeen välillä auttavat beetakierteen muodostumisessa.

Kuva 02: Beta Helix
Beta-helikset voivat olla sekä oikea- että vasenkätisiä niiden sidontakuvioiden mukaan. Muodostettaessa beeta-heliksia kahden beetalevyn muuttuvat ryhmät asettuvat kierteen ytimeen. Siksi suurimmalla osalla beetalevyjä muodostavista ryhmistä on hydrofobisia toimintoja.
Toisin kuin alfakierteessä, 17 jäännöstä muodostaa yhden kierroksen beetaheliksissä. Metalli-ioneilla on kyky aktivoida beetakierteen muodostumista. Alfa-heliksin tapaan vetysidokset tukevat beta-kierteen rakenteen ylläpitämistä. Hiilihappoanhydraasientsyymi ja pektaattilyaasi ovat kaksi proteiinia, joissa on runsaasti beetaheliksiä.
Mitä yhtäläisyyksiä alfan ja betahelixin välillä on?
- Alfa ja Beta Helix ovat kaksi proteiinien toissijaista rakennetta.
- Aminohapot ovat molempien sekundäärirakenteiden monomeerejä.
- Lisäksi alfa- ja beetaheliksien kemialliset ainesosat ovat hiili, vety, happi, typpi ja rikki.
- Myös molemmat toissijaiset rakenteet kehittyvät korkeamman tason organisaatioksi.
- Lisäksi molemmat ovat stabiloituja vetysidoksilla.
- Molemmissa rakenteissa hydrofobisuuden määrää aminohappojen R-ryhmien läsnäolo.
Mitä eroa on Alpha- ja Beta Helixillä?
Avainero alfa- ja beetakierteen välillä on niiden vetysidoksen tyyppi. Alfa-kierre osoittaa molekyylinsisäistä vetysidosta, kun taas beetaheliksi osoittaa molekyylien välistä vetysidosta. Lisäksi alfaheliksi muodostaa oikeakätisen kierteen, kun taas beetakierre voi muodostaa sekä oikea- että vasenkätisiä heliksiä. Tämä on siis myös merkittävä ero alfa- ja beetakierteen välillä.
Lisäksi lisäero alfa- ja beetakierteen välillä on se, että alfa-kierteen muodostuminen tapahtuu aminohapposekvenssin kiertymisen myötä, kun taas beeta-heliksin muodostuksessa kaksi beeta-levyä joko rinnakkain tai anti-rinnakkaisena on sitoutunut muodostavat kierteisen rakenteen.
Alla olevassa infografiikassa on lisätietoja alfa- ja beetaheliksien eroista.

Yhteenveto - Alpha vs Beta Helix
Sekä alfa- että beetaheliksit ovat tärkeitä monimutkaisten proteiinirakenteiden tunnistamisessa ja päättelyssä. Molemmat tyypit ovat proteiinien toissijaisia rakenteita. Alfaheliksi on kuitenkin aminohapposekvenssien kierre. Sitä vastoin beetaheliksin muodostuminen tapahtuu rinnakkaisten tai anti-rinnakkaisbeetalevyjen vetysidoksen kautta. Lisäksi vetysidos on molekyylinsisäinen alfa-heliksimuodossa, kun taas vetysidos on molekyylien välinen beeta-heliksimuodossa. Lisäksi molemmissa näissä rakenteissa on R-ryhmä, joka määrää proteiinin hydrofobisuuden. Näin ollen tämä tiivistää alfa- ja beetakierteen eron.






